Cada uno de los elementos que forman parte de la tabla periódica, o compuestos que se generan a partir de combinaciones de elementos iniciales o compuestos mas pequeños, pueden existir en tres estados diferentes: sólido,
líquido y gaseoso en dependencia de las condiciones de presión y temperatura en
las que se encuentren y esto se debe básicamente a las fuerzas intermoleculares. Es por ello que existen formas de visualizar gráficamente estos estados, una de ellas son los diagramas de fases.
Sin embargo, antes de dar inicio, es importante recordar algunas definiciones que se le pueden dar al termino fase. Particularmente en este caso, podemos encontrar tres, que hacen alusión al mismo aspecto:
- Una fase es una parte homogénea de un sistema, que aunque está en contacto con otras partes del sistema, está separado por un límite bien definido.
- Es una región del material con propiedades físicas y químicas homogéneas.
- Es una región que difiere en su microestructura y/o composición, de otra región.
DIAGRAMAS DE FASES PARA SUSTANCIAS PURAS
Existen diferentes diagramas de estos tipos según las propiedades de los materiales. También pueden darse casos particulares. Los pares (presión, temperatura) que corresponden a una
transición de fase entre:
- Dos fases sólidas: Cambio alotrópico.
- Entre una fase sólida y una fase líquida: fusión - solidificación.
- Entre una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación inversa).
- Entre una fase líquida y una fase vapor: vaporización - condensación (o licue facción).
Es importante señalar que la curva que separa las fases
vapor-líquido se detiene en un punto llamado punto crítico (La densidad del
líquido y vapor son iguales). Más allá de este punto, la materia se presenta
como un fluido supercrítico que tiene propiedades tanto de los líquidos como de
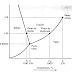
los gases. Es preciso anotar que, en el diagrama P-T del agua, la línea
que separa los estados líquido y sólido tiene pendiente negativa, lo cual es
algo bastante inusual. Esto quiere decir que aumentando la presión el hielo se
funde, y también que la fase sólida tiene menor densidad que la fase líquida.
Figura #1: Diagrama de Fases del Agua
REGLA DE FASES DE GIBBS
La regla de las fases establece la relación que existe en el
equilibrio entre las fases presentes, los componentes y las variables de estado
necesarias para especificar el estado del sistema. Es una regla completamente
general; la mayor dificultad para su aplicación consiste en que a veces resulta
difícil determinar exactamente cuáles son los componentes del sistema. Esta
regla nos define los grados de libertad que posee el sistema dependiendo del
tipo de variables que consideremos. Establece la siguiente relación:
F = C - P + 2
Donde:
- F = número de grados de libertad.
- C = número de componentes.
- P = número de fases presentes.
- 2 = es el número de variables de estado del sistema (temperatura y presión).
Figura #2: Diagrama de Fases para un sistema Binario en relación con regla de Gibbs
DIAGRAMAS DE FASES PARA SISTEMAS BINARIOS
Cuando aparecen varias sustancias, la representación de los
cambios de fase puede ser más compleja. Un caso particular, el más sencillo,
corresponde a los diagramas de fase binarios. Ahora las variables a tener en
cuenta son la temperatura y la concentración, normalmente en masa. Hay punto y líneas en estos diagramas importantes para su
caracterización:
- Sólido puro o solución sólida
- Mezcla de disoluciones sólidas (eutéctica, eutectoide, peritéctica, peritectoide)
- Mezcla sólido - líquido
- Únicamente líquido, ya sea mezcla de líquidos inmiscibles o un líquido completamente homogéneo.
- Mezcla líquido - gas
- Gas (lo consideraremos siempre homogéneo, trabajando con pocas variaciones da altitud).
En un diagrama binario pueden aparecer las siguientes
regiones:
- Línea de liquidus, por encima de la cual solo existen fases líquidas.
- Línea de solidus, por debajo de la cual solo existen fases sólidas.
- Línea eutéctica y eutectoide. Son líneas horizontales (isotermas) en las que tienen lugar transformaciones eutécticas y eutectoides, respectivamente.
- Línea de solvus, que indica las temperaturas para las cuales una disolución sólida (α) de A y B deja de ser soluble para transformarse en dos disoluciones sólidas (α) + (β) de distinta composición en A y B.
Puntualmente, para efectos de este blog, se definirán dos casos de estos tipos de sistemas: isomorfo y eutéctico.
- Sistema Isomorfo: Un diagrama de fases muestra las fases y sus composiciones para cualquier combinación de temperatura y composición de la aleación. Cuando en la aleación sólo están presentes dos elementos, se puede elaborar un diagrama de fases binario. Se encuentran diagramas de fases binarios isomorfos en varios sistemas metálicos y cerámicos. En los sistemas isomorfos, sólo se forma una fase sólida; los dos componentes del sistema presentan solubilidad sólida ilimitada
Figura #3: Diagrama de Fases para sistema Isomorfo














0 comentarios:
Publicar un comentario