Solidificación
La solidificación es un proceso físico que se produce cuando hay
cierto cambio de estado de la materia. Por ejemplo un líquido se transforma en
sólido por la disminución en la temperatura o por la compresión del material. Podemos
observar fácilmente el proceso de solidificación cuando colocamos agua en el
congelador y luego de un rato por la baja temperatura se vuelve hielo sólido.
Esto provoca que al cambiar de estado aumenta el volumen.
El punto de solidificación es la temperatura que se requiere
para que se transforme un líquido a sólido. En general los líquidos puros
tienen el mismo punto de solidificación que de fusión, por lo que este tipo de
sustancias están en equilibrio.
La temperatura de solidificación es de 0 ºC por lo cual al
enfriarse el líquido a este nivel se vuelve sólido. En la mayoría de los
líquidos al congelarse pierden volumen pero el agua aumenta el volumen,
por lo que ocupa más espacio.
Por esta razón no se debe llenar las cubetas de agua hasta
arriba porque si no los cubitos se salen del molde. En cambio sí se coloca agua
hasta la mitad se logrará llenar sin que rebose por el incremento del volumen.
Etapas de la solidificación
Metales puros
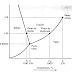
Las etapas de la solidificación de un metal puro se pueden ver en
el gráfico: en un principio solidifican puntos muy concretos en una etapa
llamada nucleación. A continuación se produce el proceso de cristalización, en el
cual más y más átomos se van agregando a esos núcleos y van formando cristales
denominados dendritas, en los que las orientaciones cristalinas son diferentes. Las
dendritas van creciendo hasta que todo el metal se ha solidificado, y las zonas
de encuentro van definiendo los llamados límites de grano. Es el
proceso final, llamado formación del grano.
Aleaciones
Los
componentes de una aleación rara vez tienen igual punto de fusión, por lo que
el metal de temperatura más alta tiende a solidificar antes, y el de punto de fusión
menor aguanta más en estado líquido. Esto significa que la solidificación de
una aleación no se realiza a temperatura constante, sino en un intervalo de
temperaturas.
Para analizar el gráfico, vamos a suponer que el
componente de color rojizo solidifica a temperatura superior que el componente
amarillo.
En la etapa de nucleación los Átomos que primero
se solidifican serán los del material rojo, y durante la etapa de cristalización
se van capturando algunos Átomos amarillos, pero son mayoría de rojos. Esto
supone que en el líquido cada vez hay menos Átomos rojos y más amarillos, es
decir, aumenta la concentración de este Último. Para producir la solidificación
de más Átomos amarillos hay que disminuir cada vez más la temperatura, y la aleación
acaba de pasar al estado sólido a una temperatura inferior a la que empezó.
Además, durante la cristalización de las aleaciones siempre se produce
el fenómeno de la segregación,
que consiste en que la periferia de las dendritas tiene una composición
distinta que el centro.
Defectos en solidificación
·
Defectos puntuales
Alteraciones
o discontinuidades puntuales de la red cristalina provocadas por uno o varios
átomos, su origen es el movimiento de átomos durante el calentamiento o el
procesado del material, introducción de impurezas o por aleación. Estos pueden
ser:
1 Vacantes: Un átomo falta de su sitio
normal en la red cristalina que su origen ocurre durante la solidificación a
alta temperatura o como consecuencia de los daños provocados por la radiación
(intencionados).
2 Defectos intersticiales: Un átomo
adicional se inserta en una posición habitualmente desocupada de la red
cristalina, estos átomos son mayores que los huecos intersticiales que ocupan y
menores que los átomos reticulares que los rodean (distorsión de la red).
3 Defecto substitucional: Substitución de
un átomo de la red cristalina por otro distinto, si el defecto substitucional
es mayor que los átomos normales la red se comprime, si es menor la red se
expande (tensión).
4 Defecto Frenkel: par de defectos
(intersticial + vacante). En un cristal iónico, un ion salta su sitio normal a
un sitio intersticial dejando una vacante.
5 Defecto Schottky: par de defectos
(vacante + vacante). En un cristal iónico, faltan simultáneamente un anión y un
catión
·
Defectos
de línea (dislocaciones)
Imperfecciones o irregularidades lineales en una red ideal o perfecta los
cuales se generan en el proceso de solidificación o proceso de moldeado. Estos
pueden ser:
1 Defecto
en cuña (borde o arista):
- Se
originan al introducir en el material un plano de átomos adicional.
- El
vector de Burgers es perpendicular a la dislocación.
- Distorsión
de la red: los átomos contiguos al plano adicional están comprimidos mientras
que el resto está expandido
2 Helicoidal
(o de tornillo):
- Se
originan cuando partes contiguas del material sufren esfuerzos cortantes paralelos pero de sentidos contrarios (cizalladura).
- El
vector de Burgers es paralelo a la dislocación.

















que buena publicación
ResponderEliminarMuy informativa compañero
ResponderEliminar